ALCOHOLES Y FENOLES
Introducción
El presente blog se desarrolla con el fin de explicar o brindar los conocimientos específicos acerca de los temas: alcoholes y fenoles, es decir, adentrarnos a la química orgánica y definir, caracterizar, representar su estructura, tipos y nomenclatura.Los alcoholes son compuestos de fórmula general R (OH)n, es decir, compuestos que contienen uno o más grupos hidroxílicos unidos a un radical alquilo. Cuando el número de grupos OH es más de uno, se conocen generalmente como alcoholes polihidroxílicos o polioles, recibiendo denominaciones particulares para cada número de grupos. El radical puede ser saturado o insaturado y de cadena abierta o cíclica. También puede ser un radical aromático, caso en el cual los alcoholes toman el nombre genérico de fenoles.
Tanto fenoles como alcoholes contienen el grupo funcional -OH (hidroxilo), que determina las propiedades características de la familia. Sin embargo los fenoles, aunque dan algunas reacciones análogas a las de los alcoholes, se diferencian de muchas otras.
La química orgánica, como parte pilar dentro de una ciencia tan experimental como lo es la química. Se llevan a tratar una serie de procesos y manejos de diversas técnicas, para trabajar variadas sustancias, dichas operaciones basadas en algún tipo de fundamento teórico.
Objetivos
- Profundizar en las propiedades física y químicas de los alcoholes y fenoles.
- Reconocer la nomenclatura de cada uno de ellos.
- Analizar el grupo funcional (-OH).
- Describir las características y ejemplos acerca del tema.
- Visualizar imágenes, vídeos y ejercicios relacionados con el contenido principal sobre alcoholes y fenoles.
- Identificar la solución de diversos ejercicios o actividades relacionados con el tema.
- Obtener un conocimiento significativo, es decir, lograr el reconocimiento del tema para toda la vida.
- Reforzar temas vistos en clase.
Marco teórico
Alcoholes


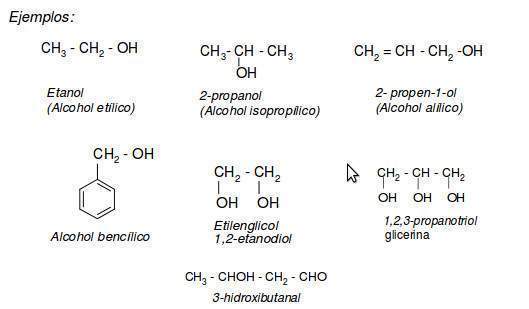
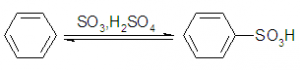
Radicales
Desarrollo de la actividad.
Fenoles 1
Fenoles 2
Corrección
Alcoholes 1
Alcoholes 2
WEBGRAFIA
Pueden ser considerados como derivados del agua.
Tienen en común, la presencia del grupo funcional
OH, conocido como grupo hidroxilo ú oxhídrilo.
- ALCOHOLES: grupo OH-unido a radical alifático (R-OH).
- FENOLES: grupo OH-unido a un radical aromático (Ar-OH).
Al igual que el agua, los alcoholes y los fenoles son bases yacidos débiles. Bases débiles, los ácidos fuertes los protonan de manera reversible; dando como resultado iones oxonio, ROH2+.
Como ácidos débiles, los alcoholes y fenoles se disocian muy poco en solución acuosa diluida donando un protón al agua.
Los alcoholes son mucho menos ácidos que los ácidos carboxílicos o los ácidos minerales, no reaccionan con las bases débiles como las aminas o el ion carbonato, reaccionan con los metales alcalinos y las bases fuertes como hidruro de sodio, amiduro de sodio y reactivos de Grignard. Los alcóxidos son bases que se utilizan a menudo como reactivos en química orgánica.
Los fenoles son más ácidos que los alcoholes por que el anión fenóxido está estabilizado por resonancia. La deslocalización de la carga negativa sobre las posiciones orto- y para- d3el anillo aromático aumenta la estabilidad del anión fenóxido comparada con el fenol no disociado y disminuye la ∆G° para la reacción de disociación.
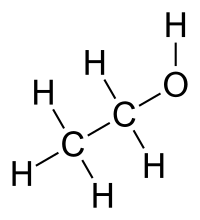
Los alcoholes son compuestos con grupos hidroxilo unidos a un átomo de carbono saturados con hibridación sp3. Además son compuestos orgánicos que contienen grupos hidroxilo, es decir, un — OH.
A partir de los alcoholes, también se pueden obtener muchos compuestos con diferentes grupos funcionales. Su estructura, es similar a la del agua, solo que se reemplaza uno de los átomos de hidrógeno del agua, por un grupo alquilo.
Como todo en la vida, los alcoholes también tienen categorías, ya que encontramos los grupos hidroxilo unidos a diferentes estructuras; una forma de organizarlos, es basándose en el tipo de átomo de carbono al que esta unido, por ejemplo, si es un carbono primario, obviamente tendremos un alcohol primario. Si esta unido a un carbono secundario, sera un alcohol secundario, por lo tanto un alcohol terciario esta unido a un carbono terciario.

PROPIEDADES FÍSICAS DE LOS ALCOHOLES
Los alcoholes alcoholes son moléculas moléculas polares polares, pero no todos son solubles solubles en agua. El OH le confiere polaridad y la posibilidad de formar puentes de hidrógeno entre ellos mismos dando “moléculas asociadas” por lo que poseen puntos de ebullición y fusión superiores a los alcanos respectivos y mayor solubilidad en agua.
La parte carbonada es apolar y resulta hidrófoba. Cuanto mayor es la longitud del alcohol su solubilidad en agua disminuye y aumenta en disolventes poco polares. Los alcoholes de uno a cuatro átomos de carbono y los polialcoholes son solubles en agua, de cinco en adelante son insolubles en agua pero solubles en solventes apolares. De uno a diez átomos de carbono son líquidos, incoloros, de olor característico. De once carbonos en adelante son sólidos, blancos y cristalinos.
La parte carbonada es apolar y resulta hidrófoba. Cuanto mayor es la longitud del alcohol su solubilidad en agua disminuye y aumenta en disolventes poco polares. Los alcoholes de uno a cuatro átomos de carbono y los polialcoholes son solubles en agua, de cinco en adelante son insolubles en agua pero solubles en solventes apolares. De uno a diez átomos de carbono son líquidos, incoloros, de olor característico. De once carbonos en adelante son sólidos, blancos y cristalinos.
MÉTODOS DE OBTENCIÓN:

A) El metanol se obtiene calentando el HH2 y CO de catalizadores minerales.
B) El etanol por fermentación de carbohidratos en presencias de levaduras.
C) Los demás alcoholes se preparan por reducción de aldehidos, cetonas de ácidos carboxilicos.
D) Los fenoles se obtienen a partir de qumeno ò isopropilbenceno.
PROPIEDADES QUÍMICAS:

1) Reacción por rompimiento de enlace o-h.
A) Reducción ácido base: Los alcoholes son ácidos muy débiles, pues su constante de disociación es menor de la del agua y deben ser atacados por bases muy fuertes.
B) Reacción especie nucleofilica: Los alcoholes actúan como especies nucleofilicas en reacciones de sustitución. También actúan así cuando reaccionan con aldehídos y cetonas.
C) Rompimiento enlace carbono- oxigeno: Se presenta cuando los alcoholes actúan como sustratos en reacciones de sustitución. Estas reacciones son similares a las de los haluros de alquilo.
D) Reacciones con H2SO4: Dependiendo de las condiciones de temperatura y concentraciones H2SO4 y actúa diferenciando productos así:
A) Soluciones divididas a baja temperatura producen sulfatos ácido o sulfatos neutros.
B) A temperatura de 140ºc el H2SO4 cataliza la formación de éteres simétricos.
C) A temperaturas superiores a 150ºc se produce la eliminación.
E) Formación de haluros: Los alcoholes no son atacados por halogenos directamente sino formando reacciones lentas.
“Los fenoles tienen propiedades similares a la de los alcoholes, pero algunas de ellas, derivan mas que nada del anillo aromático al que se encuentran enlazados.”
NOMENCLATURA: Reglas IUPAC
Se nombra la cadena más larga de carbonos que contiene al átomo de carbono enlazado con el grupo — OH. En la terminación “ano”, “eno” o “ino”, se sustituye la “o” por “ol”.
La cadena de carbonos (más larga), se nombrara comenzando por el extremo más cercano al grupo — OH. “El grupo hidroxilo tiene preferencia sobre los dobles o triples enlaces.”
Se nombran los demás sustituyentes precedidos de los números de carbonos sobre los que están localizados, así como para nombrar a los alcanos o alquenos.
Ejemplo:
 La cadena de carbonos más larga tiene cuatro, por lo tanto, su nombre base es butanol.
La cadena de carbonos más larga tiene cuatro, por lo tanto, su nombre base es butanol.
El grupo — OH se encuentra en el carbono 2, por lo que sería: butan-2-ol. Entonces, siguiendo las reglas IUPAC, el nombre de este compuesto es: 1-bromo-3,3- dimetilbutan-2-ol.
En el caso de los alcoholes ciclicos, se nombran utilizando el prejifo “ciclo”. Al carbono que este unido al grupo — OH se le da el número uno.

Los alcoholes que tienen dos grupos — OH, se llaman dioles. Y se nombran exactamente igual que los alcoholes, solo que se usará el sufijo “diol” y los numero del carbono en el que estarán, por ejemplo: “Hexa-1,5-diol”, es decir que si hay más de un grupo –OH se utilizan los términos –diol, -triol, etc, según el número de grupos hidroxilo presentes, eligiéndose como cadena principal, la cadena más larga que contenga el mayor número de grupos –OH, de forma que se le asignen los localizadores más bajos.
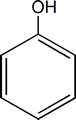
Cuando el grupo –OH se encuentra unido a un anillo aromático (benceno) el compuesto recibe el nombre de fenol. Cuando el grupo –OH va como sustituyente se utiliza el prefijo hidroxi-.
Fenoles
Se nombra la cadena más larga de carbonos que contiene al átomo de carbono enlazado con el grupo — OH. En la terminación “ano”, “eno” o “ino”, se sustituye la “o” por “ol”.
La cadena de carbonos (más larga), se nombrara comenzando por el extremo más cercano al grupo — OH. “El grupo hidroxilo tiene preferencia sobre los dobles o triples enlaces.”
Se nombran los demás sustituyentes precedidos de los números de carbonos sobre los que están localizados, así como para nombrar a los alcanos o alquenos.
Ejemplo:

El grupo — OH se encuentra en el carbono 2, por lo que sería: butan-2-ol. Entonces, siguiendo las reglas IUPAC, el nombre de este compuesto es: 1-bromo-3,3- dimetilbutan-2-ol.
En el caso de los alcoholes ciclicos, se nombran utilizando el prejifo “ciclo”. Al carbono que este unido al grupo — OH se le da el número uno.

Los alcoholes que tienen dos grupos — OH, se llaman dioles. Y se nombran exactamente igual que los alcoholes, solo que se usará el sufijo “diol” y los numero del carbono en el que estarán, por ejemplo: “Hexa-1,5-diol”, es decir que si hay más de un grupo –OH se utilizan los términos –diol, -triol, etc, según el número de grupos hidroxilo presentes, eligiéndose como cadena principal, la cadena más larga que contenga el mayor número de grupos –OH, de forma que se le asignen los localizadores más bajos.
Cuando el grupo –OH se encuentra unido a un anillo aromático (benceno) el compuesto recibe el nombre de fenol. Cuando el grupo –OH va como sustituyente se utiliza el prefijo hidroxi-.

Fenoles
Su Fórmula química es C6H5OH, y tiene un Punto de fusión de 43 °C y un Punto de ebullición de 182 °C. Los fenoles son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH. El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.

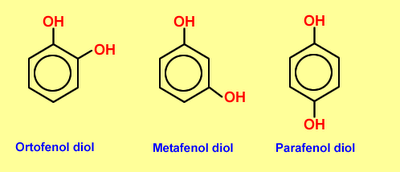
Si existen 2, 3 o más grupos OH se denominaran difenoles, trifenoles o polifenoles respectivamente. Cuando los sustituyentes del anillo estan vecinos se los llama con el prefijo orto (o). Si hay un lugar de separación entre ellos es meta (m) y si estan en lados opuestos para (p).

El fenol no existe en estado libre.
Se forma en la destilación seca de la hulla. Luego se destilan los aceites medios del alquitrán de hulla.
Por este método se obtiene poca cantidad. Por este motivo se lo prepara hoy sintéticamente.
A partir de la formación del ácido bencenosulfónico:
En la primera etapa el benceno reacciona con el ácido sulfúrico:
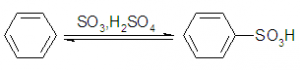
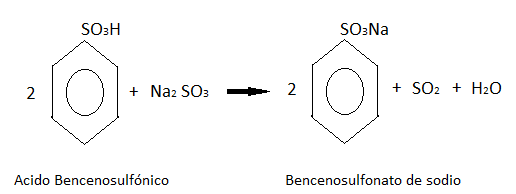
Este ácido formado después reacciona con el sulfito de sodio, dando como producto bencenosulfonato de sodio.

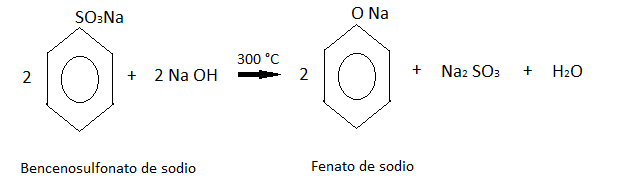
El bencenosulfonato de sodio después se concentra por evaporación y se combina con hidróxido de sodio.

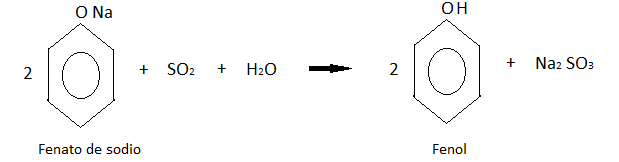
Este último producto se acidifica con dióxido de azufre de una de las reacciones anteriores, obteniendo finalmente al fenol.

Usos del Fenol: Se usa para la fabricación de resinas sintéticas, ácido pícrico (usado a su vez para explosivos), ácido salicílico (materia prima para las aspirinas), colorantes, etc. Se ha usado mucho tiempo como agente antiséptico.
Propiedades del Fenol:
Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
Es poco soluble en agua. Muy soluble en éter y alcohol.
Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Con respecto a las reacciones, hay de dos tipos. Las que se relacionan con el grupo OH y aquellas en las que participa el anillo.
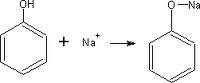
Formación de sales: El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.

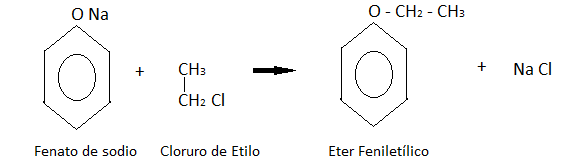
Formación de éteres: Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.

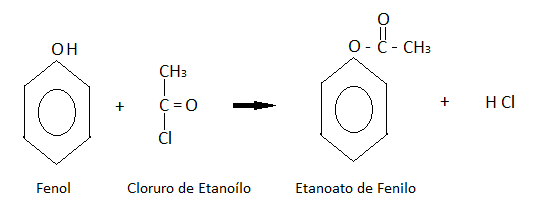
Formación de ésteres:
El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.

Entre las reacciones del anillo aromático, es decir, de sustitución, podemos nombrar las principales.
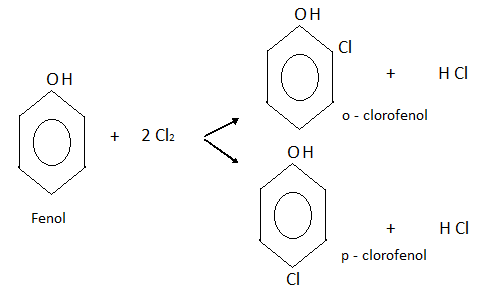
Halogenación:
Haciendo reaccionar al fenol con cloro, por ejemplo, se obtiene una mezcla de o-clorofenol y p-clorofenol.

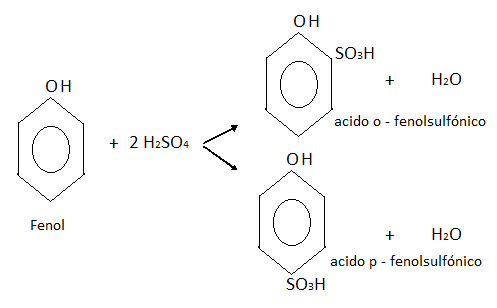
Sulfonación:
El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.

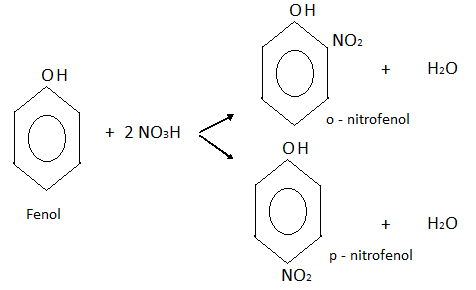
Nitración:
En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.

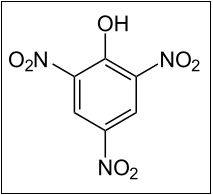
Si el ácido nítrico fuera más concentrado, obtendríamos el 2,4,6,-trinitrofenol también llamado ácido pícrico.

RIESGOS: El fenol se evapora más lentamente que el agua y una pequeña cantidad puede formar una solución con agua. Se puede detectar el sabor y el olor del fenol a niveles más bajos que los asociados con efectos nocivos. El fenol se inflama fácilmente, es corrosivo y sus gases son explosivos en contacto con fuego.
De ser ingerido en altas concentraciones, puede causar envenenamiento, vómitos, decoloración de la piel e irritación respiratoria. Era la sustancia utilizada en los campos de concentración nazis desde agosto de 1941 para disponer de las llamadas "inyecciones letales" (inyección de fenol de 10 cm³). Desafortunadamente es uno de los principales desechos de industrias carboníferas y petroquímicas; como consecuencia el fenol entra en contacto con cloro en fuentes de agua tratadas para consumo humano, y forma compuestos fenilclorados, muy solubles y citotóxicos por su facilidad para atravesar membranas celulares.
Nomenclatura de los fenoles
Para nombrar los fenoles se utiliza la terminación -ol precedida del nombre del hidrocarburo aromático correspondiente.
Si existen varios radicales -OH, se numeran los átomos de carbono del benceno de modo que los carbonos con grupos hidroxilo les corresponda la numeración más baja en conjunto, si hay varias posibilidades decidirá el orden de preferencia alfabético de los radicales.; al nombrar los polifenoles, deben escribirse los localizadores y los prefijos correspondientes: di, tri, etc. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
La IUPAC admite algunos nombres comunes: Pirocatecol, Resorcinol, Hidroquinona y Xilol.
Los radicales de los fenoles Ar — O—, se nombran añadiendo la terminación -oxi al nombre del radical: (C6H5) — O —, fenoxi, etc
Fenoles 1
Fenoles 2
Corrección
Alcoholes 1
Alcoholes 2
WEBGRAFIA
- http://agrega.juntadeandalucia.es/repositorio/31082016/f3/es-an_2016083113_9133751/5_alcoholes_y_fenoles.html
- https://es.slideshare.net/mmusic1996/alcoholes-y-fenoles-16788577
- https://medium.com/@salmaG/qu%C3%ADmica-org%C3%A1nica-nomenclatura-de-alcoholes-y-fenoles-bffaf421e43f
- http://quimicaorganicaupn2011.blogspot.com/2011/03/alcoholes-y-fenoles.html
- http://paolapekemoxa.blogspot.com/2011/12/capitulo-17-alcoholes-y-fenoles.html
- https://www.ecured.cu/Fenol













BUEN TRABAJO 5,0
ResponderBorrar