
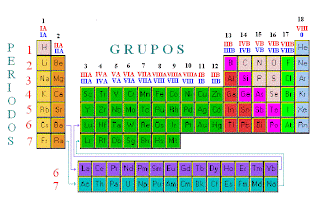
Grupos de la tabla periódica
Introducción: El presente trabajo se realiza o desarrolla con la intención de conocer todo (definición, características, métodos, historia,...) sobre algunos grupos y elementos específicos de la tabla periódica. Con esto se busca obtener conocimientos de manera explicativa y didáctica, ya que por medio de imágenes y vídeos podremos observar diversas explicaciones y ejemplos. Es normal que muchos de estos grupos correspondan a
conocidas familias de elementos químicos, ya que la tabla periódica se ideó
para ordenar estas familias de una forma coherente y fácil de ver. Esto se debe
a que los elementos que están en el grupo tienen una configuración electrónica
similar. Actualmente la forma en la que se suelen numerar los 18 grupos es
empleando el sistema recomendado por la IUPAC (International Union of Pure and
Applied Chemistry) en 1985, que consiste en utilizar números arábigos. De esta
forma la primera columna es el grupo 1, la segunda el grupo 2, y así hasta la
decimoctava que corresponde al grupo 18. Anteriormente a la forma de la IUPAC
existían dos maneras de nombrar los grupos empleando números romanos y letras,
un sistema europeo y otro estadounidense, ambos cada vez más en desuso.
Objetivos: Los principales propósitos que se tienen con este blog son:
↬ Reconocer y profundizar en todas las características de los grupos de la tabla periódica (Grupo IV: carbono, Grupo V: nitrógeno, grupo VI:oxigeno y Grupo VII: cloro, bromo, yodo y flúor).
↬ Visualizar imágenes y vídeos sobre sus propiedad físicas y químicas, compuestos y demás.
↬ Analizar las diferencias entre un grupo y otro según su definición, obtención y composición.
↬ Identificar los elementos que pertenecen a los grupos nombrados de la tabla periódica.
↬Obtener un aprendizaje significativo, es decir, que se logre aprender para toda la vida todos estos conocimientos.
Un grupo es una
columna de la tabla periódica de los elementos.
Hay 18 grupos en la tabla periódica estándar.
No es coincidencia que muchos de
estos grupos correspondan a conocidas familias de elementos químicos, ya que la tabla
periódica se ideó para ordenar estas familias de una forma coherente y fácil de
ver. La explicación moderna del ordenamiento en la tabla periódica es que
los elementos de un grupo tienen configuraciones electrónicas similares
en los niveles de energía más exteriores; y como la mayoría de las propiedades
químicas dependen profundamente de las interacciones de los electrones que
están colocados en los niveles más externos los elementos de un mismo grupo
tienen propiedades físicas y especialmente químicas parecidas.
Numeración de los grupos
Actualmente la forma en la que se
suelen numerar los 18 grupos es empleando el sistema recomendado por la IUPAC (International
Union of Pure and Applied Chemistry) en 1985, que consiste en utilizar números
arábigos. De esta forma la primera columna es el grupo 1, la segunda el grupo
2, y así hasta la decimoctava que corresponde al grupo 18.
Anteriormente a la forma de la
IUPAC existían dos maneras de nombrar los grupos empleando números romanos y
letras, un sistema europeo y otro estadounidense, ambos cada vez más en desuso.
En el sistema europeo primero se pone el número romano y luego una A si el
elemento está a la izquierda o una B si lo está a la derecha. En el
estadounidense se hace lo mismo pero la A se pone cuando se trata de elementos representativos
(grupos 1, 2 y 13 a 18) y una B para los elementos de transición. En ambos
casos, los grupos se numeran del I al VIII, comprendiendo el grupo octavo de
los elementos de transición tres columnas de la tabla periódica que se
denominan tríadas.
IUPAC
|
Europa
|
EE. UU.
|
Nombre
|
Grupo 1
|
IA
|
IA
|
Metales alcalinos
|
Grupo 2
|
IIA
|
IIA
|
Metales alcalinotérreos
|
Grupo 3
|
IIIA
|
IIIB
|
Metales de transición
Los elementos del bloque f,
lantánidos y actínidos
reciben la denominación de
metales de transición interna
o tierras raras.
|
Grupo 4
|
IVA
|
IVB
|
|
Grupo 5
|
VA
|
VB
|
|
Grupo 6
|
VIA
|
VIB
|
|
Grupo 7
|
VIIA
|
VIIB
|
|
Grupo 8
|
VIIIA
|
VIIIB
|
|
Grupo 9
|
|||
Grupo 10
|
|||
Grupo 11
|
IB
|
IB
|
|
Grupo 12
|
IIB
|
IIB
|
|
Grupo 13
|
IIIB
|
IIIA
|
Térreos
|
Grupo 14
|
IVB
|
IVA
|
Carbonoides
|
Grupo 15
|
VB
|
VA
|
Nitrogenoides
|
Grupo 16
|
VIB
|
VIA
|
Anfígenos o calcógenos
|
Grupo 17
|
VIIB
|
VIIA
|
Halógenos
|
Grupo 18
|
VIIIB
|
VIIIA
|
Gases nobles
|
La familia IVA son los carbonoideos, no metales. A medida que se desciende en el grupo, aumenta el carácter metálico de sus componentes. el C y el Si son no metales, el germanio es un semimetal y el Sn junto con el Pb son netamente metálicos. El C y el Si tienden a formar uniones covalentes para completar su octeto electrónico, mientras que el Sn y el Pb tienden a ceder, por su carácter metálico.
La familia VA son los no metales nitrogenoideos. El N y el P son no metálicos, el arsénico y el antimonio son semimetales, a veces se comportan como metales y otras como no metales (esto es carácter anfótero). El Bi es un metal. esta variación de no metálico a metálico, a medida que se avanza en el grupo, se debe al aumento del tamaño de los átomos. resulta más difícil separar un electrón del átomo de N que hacerlo con el de Bi, porque en el primero la atracción nuclear es más intensa. Las moléculas de N son biatómicas, el P, As, Sb presentan moléculas tetratómicas en algunos de sus estados alotrópicos. el Bi es biatómico. todos estos elementos forman enlaces covalentes.
La familia VIA son los no metales calcógenos. Sus puntos de fusión, densidad y ebullición aumentan a medida que se desciende en el grupo, es decir a medida que aumenta el tamaño de los átomos. Se combinan con el H para formar hidruros no metálicos. De acuerdo a la electronegatividad, la afinidad química con el H decrece del O al Te. Cuando se combinan con el H, su número de oxidación de -2, pero cuando lo hacen con elementos más electronegativos presentan numero de oxidación positivo (4 , 6)
La familia VIIA se compone de los halógenos. Todos ellos tienden a ganar un solo electrón en las reacciones. Miembros importantes de la familia incluyen el cloro (Cl), que se utiliza en la fabricación de la sal de mesa y cloro, y el yodo (I).
La familia VA son los no metales nitrogenoideos. El N y el P son no metálicos, el arsénico y el antimonio son semimetales, a veces se comportan como metales y otras como no metales (esto es carácter anfótero). El Bi es un metal. esta variación de no metálico a metálico, a medida que se avanza en el grupo, se debe al aumento del tamaño de los átomos. resulta más difícil separar un electrón del átomo de N que hacerlo con el de Bi, porque en el primero la atracción nuclear es más intensa. Las moléculas de N son biatómicas, el P, As, Sb presentan moléculas tetratómicas en algunos de sus estados alotrópicos. el Bi es biatómico. todos estos elementos forman enlaces covalentes.
La familia VIA son los no metales calcógenos. Sus puntos de fusión, densidad y ebullición aumentan a medida que se desciende en el grupo, es decir a medida que aumenta el tamaño de los átomos. Se combinan con el H para formar hidruros no metálicos. De acuerdo a la electronegatividad, la afinidad química con el H decrece del O al Te. Cuando se combinan con el H, su número de oxidación de -2, pero cuando lo hacen con elementos más electronegativos presentan numero de oxidación positivo (4 , 6)
La familia VIIA se compone de los halógenos. Todos ellos tienden a ganar un solo electrón en las reacciones. Miembros importantes de la familia incluyen el cloro (Cl), que se utiliza en la fabricación de la sal de mesa y cloro, y el yodo (I).
GRUPO IVA-CARBONO
El grupo de carbono es un grupo de la tabla periódica
integrado por los elementos: carbono (C), silicio (Si), germanio (Ge), estaño
(Sn), plomo (Pb) En la notación moderna de la IUPAC se lo llama Grupo 14. En el
campo de la física de los semiconductores, todavía es universalmente llamado
Grupo IV.
Estos elementos componen más del 28% en masa de la corteza,
siendo el silicio el más abundante, luego seguido del carbono. El germanio es
el elemento menos abundante.
El silicio es el elemento principal de toda la estructura
inorgánica y el carbono es el responsable de la vida orgánica de la superficie
terrestre.
Los elementos metálicos de este grupo están clasificados en
la tabla periódica como “otros metales” junto a los grupos 13 y 15. Poseen
cuatro electrones en su nivel energético más externo y presentan la siguiente
configuración electrónica: ns2np2 (2 electrones s y 2 electrones p),
exhibiendo los siguientes estados de oxidación: +4, +2 y -4: los compuestos con
+4 y la mayoría de los de número de oxidación +2 son covalentes. El único ion
-4 es el carburo.
Propiedades físicas: Las propiedades físicas de este grupo varían mucho en cada
elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
Por ejemplo, el primer elemento del grupo, el carbono es un
no metal duro y sólido a temperatura ambiente. Este elemento puede encontrarse
en la naturaleza en forma de carbono amorfo (grafito) y en forma de diamante.
Ambas formas alotrópicas poseen coloraciones distintas, siendo el grafito de
color negro y el diamante incoloro.
Alótropos
El carbono posee
varios alótropos.
El más común es el grafito, que es el carbono en forma de hojas apiladas. Otra
forma de carbono es el diamante. Una tercera
forma alotrópica del carbono es el fullereno, que tiene la forma de láminas de
átomos de carbono dobladas que forman una esfera. Un cuarto alótropo del
carbono, descubierto en 2003, se llama grafeno, y está en forma de una capa de
átomos de carbono dispuestos en forma similar a la de un panal.
El silicio tiene
dos alótropos, el amorfo y el cristalino. El alótropo amorfo es un polvo
marrón, mientras que el alótropo cristalino es gris y tiene un brillo metálico.
El estaño tiene dos
alótropos: α-estaño, también conocido como estaño gris, y β-estaño. El estaño
se encuentra típicamente en la forma β-estaño. Sin embargo a presión normal el
β-estaño se convierte a α-estaño, pasando de un metal plateado a un polvo gris,
a temperaturas inferiores a los 56º Fahrenheit. Esto puede hacer que los
objetos de estaño a temperaturas bajas se desmoronen en un proceso conocido
como "la pudrición del estaño".
Núcleo atómico
Al menos dos de los
elementos del grupo IV (estaño y plomo) tienen núcleo mágicos, lo que significa
que estos elementos son más comunes y más estables que los elementos metálicos
que no tiene un núcleo mágico.
Isótopos
Existen 15 isótopos
conocidos de carbono. De ellos, tres son de origen natural. El más común de
todos ellos es el carbono-12 estable, seguido por el carbono-13 estable.El carbono-14 es un isótopo
radiactivo natural con una vida media de 5.730 años.
Se han descubierto
23 isótopos de silicio, cinco de ellos son de origen natural. El más común es
de silicio-28 estable, seguido de silicio-29 estable y estable de silicio-30.
Silicio-32 es un isótopo radiactivo que se produce naturalmente como un
resultado de la desintegración radiactiva de los actínidos. Silicio-34 también
se produce de forma natural como resultado de la desintegración radiactiva de
los actínidos.
Hasta el momento se
han descubierto 32 isótopos de Germanio, cinco de ellos son de origen natural.
El más común es el isótopo estable de germanio-74, seguido por el isótopo
estable de germanio-72, el isótopo estable de germanio-70, y el isótopo estable
de germanio-73. El isótopo de germanio-76 es un radioisótopo.
Se han descubierto
40 isótopos de estaño, 14 de ellos se producen en la naturaleza. El más común
es el isótopo estable estaño-120, seguido por el isótopo estable estaño-118, el
isótopo estable estaño-116, el isótopo estable estaño-119, el isótopo estable
estaño-117, el radioisótopo estaño-124, el isótopo estable estaño-122m el
isótopo estable estaño-112 y el isótopo estable estaño-114. El estaño también
tiene cuatro radioisótopos que se producen como resultado de la desintegración
radiactiva de uranio. Estos isótopos son el estaño-121, estaño-123, estaño-125,
y el estaño-126.
Se han descubierto
38 isótopos de plomo, 9 de ellos son de origen natural. El isótopo más común es
el radioisótopo plomo-208, seguido por el plomo-206, el radioisótopo plomo-207,
y el radioisótopo plomo-204. Cuatro isótopos de plomo se producen a partir de
la desintegración radiactiva del uranio y el torio. Estos isótopos son el
plomo-209, el plomo-210, el plomo-211 y plomo-212.
Propiedades químicas: Los elementos del grupo 14 poseen algunas propiedades
químicas similares, entre estas tenemos:
- No reaccionan con el agua.
- El germanio, estaño y plomo son atacados por los ácidos.
- Son atacados por disoluciones alcalinas desprendiendo hidrógeno, a excepción del elemento carbono.
- Reaccionan con el oxígeno formando óxidos. Siendo los óxidos de carbono y silicio ácidos, el de estaño anfótero (es decir, que reacciona con ácidos y bases calientes) y lo mismo sucede con el plomo.
- Al formar hidruros presentan la habilidad de formar concatenación. La concatenación es la propiedad que poseen algunos elementos de unirse con otro átomo del mismo elemento para formar cadenas ya sea lineales ramificadas o cíclicas. Esta predisposición disminuye al descender en el grupo. La concatenación se le atribuye al elemento carbono, aunque también es un fenómeno suscitado en el silicio. Este fenómeno es la raíz de la química orgánica.
Z
|
Elemento
|
Distribución electrónica/valencia
|
6
|
Carbono
|
2, 4
|
14
|
Silicio
|
2, 8, 4
|
32
|
Germanio
|
2, 8, 18, 4
|
50
|
Estaño
|
2, 8, 18, 18, 4
|
82
|
Plomo
|
2, 8, 18, 32, 18, 4
|
Descubrimiento
El carbono, estaño y plomo son algunos de los elementos bien
conocidos en el mundo antiguo, junto con azufre, hierro, cobre, mercurio, plata y oro.
Carbono como elemento fue utilizado por el primer ser humano
para manejar carbón de un incendio.
El Silicio como sílice en forma de cristal de roca era
familiar a los egipcios predinásticos, que lo utilizaron para los granos y
pequeños jarrones.
Los orígenes de estaño parecen estar perdido en la historia.
Parece que el bronce, que es una aleación de cobre y estaño, fue utilizado por
el hombre prehistórico y algún tiempo antes se aisló el metal puro.
El plomo se menciona a menudo en relatos bíblicos. Los
babilonios utilizaban el metal en forma de placas en los que grababan
inscripciones. Los romanos lo utilizaron para las tabletas, tuberías de agua,
monedas y utensilios de cocina; de hecho, como resultado de la última
utilización, el envenenamiento por plomo fue reconocido en la época de Augusto
César.
Aplicaciones
El carbono es comúnmente utilizado en su forma amorfa. En
esta forma el carbono se utiliza para la fabricación de acero, como relleno en
los neumáticos, y como carbón activado. El carbono grafito se utiliza en los
lápices. El diamante, otra de las formas del carbono, se utiliza comúnmente en
la joyería. Las fibras de carbono se utilizan en numerosas aplicaciones, tales
como puntales de satélite, debido a que las fibras son muy fuertes pero
elásticas.
El dióxido de silicio tiene una amplia variedad de
aplicaciones, incluyendo pasta de dientes,materiales de construcción, y la
sílice es un uno de los componentes principales del vidrio.
El germanio se utilizó en los semiconductores hasta la
década de 1950, cuando fue sustituido por el silicio. Los detectores de
radiación contienen germanio. El óxido de germanio se utiliza en la fibra
óptica.
El uso más importante del estaño es en soldaduras; 50% de
todo el estaño producido se destina a esta aplicación. Un 20% del estaño
producido se utiliza en la hojalata. Otro 20% del estaño se utiliza en la
industria química.
Alguna de las aplicaciones del plomo son las pesas, pigmentos
y como protección contra materiales radioactivos. El plomo fue utilizado
históricamente en la gasolina en forma de tetraetilo de plomo.
Producción
Carbono en forma de diamante se produce sobre todo por parte
de Rusia, Botswana, Congo, Canadá y Sudáfrica. Un 80% de todos los diamantes sintéticos
son producidos por Rusia. China produce un 70% de grafito en el mundo. Otros
países que producen grafito son Brasil, Canadá y México.
El silicio se puede producir por calentamiento de sílice con
carbono.
En Rusia y China, el germanio también se separa de los
yacimientos de carbón. Minerales que contienen germanio son tratados primero
con el cloro para formar tetraclururo de germanio, que se mezcla con el gas
hidrógeno.
China, Indonesia, Perú, Bolivia y Brasil son los principales
productores de estaño.
El mineral de plomo más extraído es la galena (sulfuro de
plomo). 4 millones de toneladas métricas de plomo se extraen cada año, la
mayoría en China, Australia, Estados unidos y perú. La cantidad total de plomo
nunca minada por los humanos es aproximadamente de 350 millones de toneladas
métricas.
GRUPO VA- NITRÓGENO
El grupo
del nitrógeno está compuesto por los elementos químicos del grupo 15 de la tabla periódica, que
son: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto(Bi)
y el elemento sintético moscovio (Mc), cuyo descubrimiento ya ha sido confirmado.
Estos elementos también reciben el nombre de pnicógenos
o nitrogenoideos.
Propiedad N P As Sb Bi
Estructura electrónica externa 2s² 2p³ 3s² 3p³ 4s² 4p³ 5s² 5p³ 6s²
6p³
Densidad (kg/m³) 1'25
(1)
1.820 5.780 6.690 8.900
Punto de fusión (°C) -210 44 814 613 271
1ª Energía de ionización (kJ/mol) 1.402 1.012 947 834 703
Electronegatividad 3'0 2'1 2'1 1'9 1'8
Estados de oxidación comunes -3,
+5 ±3, +5 ±3,
+5 ±3, +5 ±3, +5
Todos ellos poseen 5 electrones de valencia (última capa s2p3) y suelen formar enlaces covalentes entre el nitrógeno y el fósforo.
Estos elementos componen el 0,33% en masa de la corteza
terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente
se encuentran en forma de compuestos ya sea
óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los
óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden
obtener los mismos.
Propiedades físicas: Las propiedades físicas de este grupo varían mucho en cada
elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
El nitrógeno es un gas diatómico inerte que forma
el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por
su parte, el fósforo es un no metal sólido de color blanco, pero puro
es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y
propiedades. Los más comunes son el fósforo blanco el más tóxico
e inflamable, el fósforo rojo es mucho más estable y menos volátil y
por último el fósforo negro, el cual presenta una estructura similar al
grafito y conduce la electricidad. Además es más denso que las otras dos formas
y no se inflama.
Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos
elementos se asemejan a los metales en sus propiedades físicas, pero se
comportan químicamente como un no metal. El arsénico es metaloide sólido y
tóxico de color gris metálico que presenta tres formas alotrópicas.
El elemento metálico de este grupo es el bismuto, el
cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los
pocos metales que se expanden al solidificarse. Su conductividad térmica es
menor que la de cualquier otro metal, con excepción del mercurio.
De manera resumida, las propiedades metálicas de este grupo
van incrementando a medida que se desciende en la tabla periódica, desde el
nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión
a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y
aumenta el carácter metálico.
Los metaloides o semimetales
de este grupo son el arsénico y antimonio. Estos elementos se
asemejan a los metales en sus propiedades físicas, pero se comportan
químicamente como un no metal. El arsénico
es metaloide sólido y tóxico de color gris metálico que presenta tres formas
alotrópicas:
El arsénico gris metálico: es la
forma más estable de las tres y es un buen conductor del calor pero bastante
malo conductor de electricidad.
El arsénico amarillo: Es
enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta
fosforescencia a temperatura ambiente.
El arsénico negro: Presenta
propiedades intermedias entre las formas anteriores.
De
igual manera, el antimonio es un semimetal que en su forma elemental es un
sólido cristalino de color blanco plateado, fundible, frágil, con una escasa
conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
Antimonio puro gris plateado
Antimonio blanco azulado: es su
forma más estable y metálica
Antimonio negro: Inestable
y no metálico
Antimonio amarillo: Inestable
y no metálico
El
elemento metálico de este grupo es el bismuto,
el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de
los pocos metales que se expanden al solidificarse. Su conductividad térmica es
menor que la de cualquier otro metal, con excepción del mercurio.
De
manera resumida, las propiedades metálicas de este grupo van incrementando a
medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto.
Por lo que ocurre una disminución de los puntos de fusión a partir del
arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el
carácter metálico.
Propiedades químicas: Los elementos del grupo 15 poseen algunas propiedades
químicas similares, entre estas tenemos:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
Usos
- El gas nitrógeno se utiliza para rellenar los neumáticos de los aviones y los automóviles (coches).
- El nitrógeno es un componente de casi todas las drogas farmacológicas y ayuda a la conservación en el campo de la medicina (muestras biológicas), y en equipos de procesamiento de datos
- Se utiliza para la fabricación de acero inoxidable.
- Se utiliza para reducir el riesgo de incendio en los sistemas militares de combustible de la aeronave.
Nitrógeno
Ocurrencia y obtención
El nitrógeno se encuentra en la naturaleza principalmente
como elemento, N2, el cual forma el 75,52% de la masa de la atmósfera (78,08%
en volumen, Tabla 4.2). También se encuentra en algunos minerales como el nitro
de Chile, NaNO3. El nitrógeno natural consiste de los isótopos 14N y 15N en la
relación 272:1. El nitrógeno, al igual que el oxígeno y los gases nobles, se
obtiene por destilación fraccionada del aire (Sección 4.2.1). Generalmente
contiene algo de argón y, dependiendo de la calidad, por encima de 30 ppm de
oxígeno. El nitrógeno espectroscópicamente puro puede prepararse por la
descomposición térmica de la azida de sodio o de bario: 2NaN3(s) → 2Na(l) +
3N2(g).
GRUPO VIA- OXÍGENO
El grupo VIA del sistema Periódico o grupo del oxígeno está
formado por los elementos: oxígeno, azufre, selenio, telurio, polonio.Por encontrarse en el extremo derecho de la Tabla Periódica
es fundamentalmente no-metálico; aunque, el carácter metálico aumenta al
descender en el grupo.
Como en todos los grupos, el primer elemento, el oxígeno,
presenta un comportamiento anómalo, ya que al no tener orbitales d en la capa de
valencia, sólo puede formar dos enlaces covalentes simples o uno doble,
mientras que los restantes elementos pueden formar 2, 4 y 6 enlaces covalentes.
El oxígeno se halla en la naturaleza siendo el elemento más
abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el
aire y combinado con hidrógeno para producir agua. También se encuentra
formando óxidos, hidróxidos y algunas sales. Por su parte, el azufre también se
muestra en cantidad en estado elemental y combinado formando compuestos. El
selenio y el telurio se hallan libres y combinados, no obstante con menos
abundancia que los elementos anteriores. En último lugar, tenemos al polonio,
el cual es un elemento radiactivo que se halla difícilmente en la naturaleza,
generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco
electrones en su nivel energético más externo y presentan la siguiente
configuración electrónica: ns2np4 (2 electrones s y 4 electrones p),
exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos
últimos se debe a la existencia de orbitales d a partir del azufre.
Propiedades físicas: Las propiedades físicas de este grupo varían mucho en cada
elemento y el carácter metálico aumenta del selenio al polonio.
El oxígeno en ambientes estándar de presión y
temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro,
inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3)
o como normalmente se le conoce, el ozono. El ozono es un gas de olor
picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente
azulado.
El azufre es un no metal sólido de color amarillo
limón que presenta un olor característico. Se presenta en varias formas
alotrópicas, por ejemplo en estado sólido se pueden apreciar las
variedades rómbica y monoclínica (anillos S8), azufre
plástico (cadenas Sn). Por su parte, en estado líquido formando anillos
S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre,
que son cadenas Sn (n = 3-10), S2.
El selenio es un metaloide que presenta, al igual
que el azufre, varias formas alotrópicas. Primero el selenio rojo coloidal,
el cual está compuesto por moléculas Se8. El selenio negro vítreoformado
por anillos Sen con n muy grande y variable (forma amorfa) y por último
el selenio gris cristalino de estructura hexagonal, la cual es la
forma más común y análoga a la del azufre plástico. Este alótropo exhibe
aspecto metálico, de hecho es un semimetal y es fotoconductor.
El telurio es un metaloide sólido de color gris plateado
similar a la forma alotrópica del selenio gris, pero con un carácter más
metálico.
Y finalmente el polonio, el cual es un metaloide
altamente radiactivo, con una química equivalente al telurio y al bismuto. Este
elemento muestra dos alótropos: el cúbico simple y el romboédrico,
en los que cada átomo está directamente rodeado por seis vecinos a distancias
iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
Propiedades químicas: Los elementos del grupo 16 ostentan algunas propiedades
químicas similares, entre estas tenemos:
- No reaccionan con el agua.
- No reaccionan con las bases a excepción del azufre.
- Reaccionan con el ácido nítrico concentrado, excepto el oxígeno.
- Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve reducida desde el oxígeno al teluro.
- Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo.
- Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo.
- Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
Estado natural
Oxígeno
El oxígeno es el elemento más abundante en el planeta
tierra. Existe en estado libre, como O2, en la atmósfera (21% en volumen), pero
también combinado en el agua y formando parte diversos óxidos y oxosales, como
silicatos, carbonatos, sulfatos, etc.
En condiciones ordinarias el oxígeno se presenta en dos
formas alotrópicas, el dioxígeno y el ozono, de los cuales sólo el primero es
termodinámicamente estable.
A diferencia del oxígeno, que se presenta en su variedad más estable como molécula diatómica O2 derivada de un enlace doble, los demás presentan estructuras derivadas de enlaces sencillos. Esto es debido a la disminución de la eficacia del solapamiento lateral a medida que aumenta el tamaño de el.
Obtención
Industrialmente, se obtiene de la destilación fraccionada
del aire líquido. A escala de laboratorio, existen diversos métodos de
obtención:
1) Electrólisis de disoluciones acuosas alcalinas.
2) Descomposición catalítica de H2O2.
3) Descomposición térmica de cloratos.
Azufre
El azufre se encuentra: nativo (en zonas volcánicas y en
domos de sal) ó combinado, en sulfatos, sulfuros (sobre todo pirita, FeS2) y
sulfuro de hidrógeno (acompañando al petróleo).
Variedades alotrópicas y sus propiedades físicas:
En estado sólido.
Variedades rómbica y monoclínica (anillos S8), azufre
plástico (cadenas Sn).
En estado líquido.
Anillos S8 y cadenas de longitud variable.
En fase gas.
Cicloazufre, cadenas Sn (n = 3-10), S2
Selenio
El selenio presenta tres formas alotrópicas:
Se rojo: constituido por moléculas Se8.
Se negro: anillos Sen con n muy grande y variable (forma
amorfa).
Se gris: de estructura similar a la del azufre plástico.
Este alótropo presenta aspecto metálico (es un semimetal) y es fotoconductor.
Teluro
Presenta una única variedad alotrópica, el Te gris, similar
al Se gris. Tiene un carácter más metálico que el anterior.
Polonio
Presenta dos alótropos: cúbico simple y romboédrico, en los
que que cada átomo está directamente rodeado por seis vecinos a distancias
iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
Pérdida de electrones
El alto valor de los potenciales de ionización, pero sobre
todo el alto poder polarizante de sus cationes (debido a su pequeño tamaño)
hacen que sólo el polonio dé lugar a sales .Sin embargo, sí que se conocen
sales de cationes poliatómicos.
Ganancia de electrones
Pueden actuar como aniones dinegativos, -2 , nunca
mononegativos, ya que la mayor energía de red de los compuestos resultantes
compensa el valor desfavorable de la electroafinidad. Dado que el tamaño del
anión -2 crece conforme se desciende en el grupo, también lo hace su
polarizabilidad, de modo que los sulfuros, seleniuros y telururos poseen un
marcado carácter covalente que aumenta en dicho sentido. Se conocen también
polianiones Eln2-.
Compartición de los electrones
Caben dos posibilidades:
- Formación de dos enlaces σ sencillos.
- Formación de un enlace doble σ + π.
GRUPO VIIA- CLORO, BROMO, YODO Y FLÚOR
Los halógenos (del griego, formador
de sales) son los elementos químicos que forman el grupo 17
(XVII A, utilizado anteriormente) o grupo VII A de la tabla periódica: flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At)
y téneso (Ts).
Este último también está en los metales del bloque f.
En estado natural se encuentran como moléculas diatómicas
químicamente activas [X2]. Para llenar por completo su último nivel energético
(s2p5) necesitan un electrón más, por lo que tienen tendencia a formar
un ion mononegativo,
X-. Este ion se
denomina haluro;
las sales que lo contienen se conocen
como haluros. Poseen una electronegatividad ≥ 2.5 según la escala de
Pauling, presentando el flúor la mayor electronegatividad, y
disminuyendo ésta al bajar en el grupo. Son elementos oxidantes (disminuyendo
esta característica al bajar en el grupo), y el flúor es capaz de llevar a la
mayor parte de los elementos al mayor estado de oxidación.
En estado natural se encuentran como moléculas diatómicas
químicamente activas [X2]. Para llenar por completo su último nivel energético
(s2p5) necesitan un electrón más, por lo que tienen tendencia a formar
un ion mononegativo,
X-. Este ion se
denomina haluro;
las sales que lo contienen se conocen como haluros.
Poseen una electronegatividad ≥ 2.5 según la escala
de Pauling, presentando el flúor la mayor electronegatividad, y
disminuyendo ésta al bajar en el grupo. Son elementos oxidantes (disminuyendo
esta característica al bajar en el grupo), y el flúor es capaz de llevar a la
mayor parte de los elementos al mayor estado de oxidación.
Muchos compuestos orgánicos sintéticos, y algunos naturales,
contienen halógenos; a estos compuestos se les llama compuestos
halogenados. La hormona tiroidea contiene átomos de yodo. Los
cloruros tienen un papel importante en el funcionamiento del cerebro mediante
la acción del neurotransmisor inhibidor de la transmisión GABA (ácido
gamma-amino butírico).
Algunos compuestos presentan propiedades similares a las de
los halógenos, por lo que reciben el nombre de pseudohalógenos.
Puede existir el pseudohalogenuro, pero no el pseudohalógeno correspondiente.
Algunos pseudohalogenuros: cianuro (CN-), tiocianato (SCN-), fulminato (CNO-),
etcétera.
Los fenicios y los griegos de la antigüedad utilizaron la
sal común para la conservación de alimentos, especialmente en la salazón del
pescado.
Propiedades físicas:
- Son elementos no metálicos.
- El carácter metálico aumenta según se desciende en el grupo, es decir, a medida que aumenta el número atómico, por lo tanto, el yodo posee brillo metálico.
- Los halógenos se presentan en moléculas diatómicas y sus átomos se mantienen unidos por enlace covalente simple y la fuerza de dicho enlace disminuye al descender en el grupo.
- Los puntos de fusión y ebullición aumentan al descender en el grupo.
- Estos elementos, a temperatura ambiente, se hallan en los tres estados de la materia: en estado sólido el iodo y ástato, en estado líquido: bromo y en estado gaseoso el flúor y cloro.
- El flúor es un gas de color amarillo claro, levemente más pesado que el aire, corrosivo y de olor fuerte e irritante.
- El cloro es un gas amarillo verdoso de olor irritante y fuerte.
- El bromo es un líquido de color rojo oscuro, muchísimo más denso que el agua, que fácilmente se evapora originando un vapor rojizo venenoso.
- El yodo es un sólido cristalino de color negro y brillante, que sublima originando un vapor violeta bastante denso, venenoso y con un olor fuerte e irritante semejante al cloro.
- El ástato es muy raro, debido a que es producto intermedio de unas series de desintegración radiactiva.
Propiedades químicas:
- Los halógenos poseen 7 electrones en su capa más externa, lo que les proporciona un número de oxidación de -1, siendo considerablemente reactivos. Dicha reactividad disminuye según aumenta el número atómico.
- De igual manera, también exhiben los estados de oxidación +1, +3, +5, +7, con excepción del flúor, el cual es el elemento más reactivo y más electronegativo del grupo y de la tabla periódica.
- Se disuelven en agua y reaccionan parcialmente con ella, a excepción del flúor que la oxida.
- Reaccionan con el oxígeno produciendo óxidos inestables. Dicha reactividad disminuye a medida que se desciende en el grupo.
- Reaccionan con el hidrógeno para originar haluros de hidrógeno, los cuales se disuelven en agua, generando los ácidos hidrácidos. El ácido más fuerte es el yoduro de hidrógeno (HI).
- Reaccionan con algunos metales formando haluros metálicos, casi todos ellos iónicos.
Estado natural
Los halógenos, que ocupan el grupo VIIA de la Tabla Periódica de 18 columnas pueden
encontrarse en la naturaleza, ya sea libres o formando numerosos compuestos.
Flúor
La palabra flúor se deriva de fluere, fundir, por emplearse el
espato flúor como fundente. Su abundancia en la naturaleza viene a ser la mitad
de la del cloro.
Principalmente se presenta en los minerales espato flúor, CaF2, criolita, Na3AlF6 y
flourapatito Ca5F(PO4)3, además forma parte de muchas aguas minerales en
pequeña proporción, así como también existe en los tallos de las gramíneas,
esmalte de los dientes, en los huesos, en la leche, orina, sangre, etc. Generalmente
los fluoruros no se encuentran disueltos, sino formando minerales como el
apatito,CaF2, 3Ca3(PO4)2, y la criolita, AlF3. 3NaF. Esta última es esencial en
la obtención del aluminio.
Cloro
No existe libre en la naturaleza, pero es el más abundante
de los halógenos (0,2 %) en estado de combinación y se presenta como anión
cloruro en el agua del mar, pozos salinos, y yacimientos de sales, combinado
con los cationes Na+, K+, Mg2+ y Ca2+.También se encuentran grandes
yacimientos de cloruro en algunos lugares de la corteza terrestre, los cuales
se originan al secarse ciertos mares interiores.
Bromo
Del griego bromos, hedor; el bromo se presenta como
anión bromuro en el agua marina, en los pozos de agua salada y en los
yacimientos salinos, también las cenizas de las algas de mar, en combinación
con la plata se encuentra en algunos puntos, formando el mineral bromuro de
plata, su abundancia no llega a la céntesima parte del cloro.
Yodo
El yodo es
el único de los halógenos que se presenta naturalmente en un estado de
oxidación positivo. Aparte de los compuestos, en los que forma aniones I- (en
el agua del mar y pozos salinos), se halla también como yodato de sodio, NaIO3,
mezclado en pequeñas cantidades con la nitratina, NaNO3, en el nitro de Chile y Perú, en el Aceite de hígado de bacalao y en
forma de yoduro argéntico.
Obtención
El flúor se obtiene por oxidación electrolítica de los
fluoruros fundidos como por ejemplo una mezcla de fluoruros de potasio e
hidrógeno.
El cloro en
pequeña escala se puede obtener por oxidación del anión cloruro con agentes
químicos por ejemplo con dióxido de manganeso: MnO3(s) + 2Cl- + 4H+ =
Mn2+ + Cl2(g) + 2H2O.
En escala comercial es más económico prepararlo por
oxidación electrolítica del cloruro sódico fundido o disuelto en agua. El bromo se suele preparar
oxidando con cloro las soluciones de los bromuros (un método consiste en hacer
pasar cloro gaseoso a través de agua marina). Puesto que el cloro es más
oxidante que el bromo, la reacción: Cl2(g) + 2Br- = Br2 + 2Cl-"
tendrá lugar en el sentido indicado. El bromo formado se separa de la solución
aireando esta, ya que es sumamente volátil. La mayor parte se obtiene oxidando
los yoduros de los pozos de agua salina por medio del cloro.
Aplicaciones
Los derivados del flúor tienen una notable importancia en el
ámbito de la industria. Entre ellos destacan los hidrocarburos fluorados, como
el anticongelante freón y la resina teflón, lubricante de notables propiedades
mecánicas. Los fluoruros son útiles como insecticidas. Además, pequeñísimas
cantidades de flúor añadidas al agua potable previenen la Caries dental.
El cloro encuentra su principal aplicación como agente de blanqueo
en las industrias papelera y textil. Asimismo se emplea en la esterilización
del agua potable y de las piscinas, y en las industrias de colorantes,
medicamentos y desinfectantes.
Los bromuros actúan médicamente como sedantes, y el bromuro
de plata se utiliza como un elemento fundamental en las placas fotográficas.
WEB GRAFÍA











LE FALTO MAS CONSULTA PARA EL TRABAJO DE GRUPOS 4,0
ResponderBorrarJUEGO FUNCIONA PERO TIENE UNAS NOMENCLATURAS MAL 4,0
DEFINITIVA 4,0